полімери біологічні
ПОЛІМЕРИ БІОЛОГІЧНІ (біополімери) - природні макромолекули, які відіграють осн. роль в біол. процесах. До П. б. відносяться білки, нуклеїнові кислоти (НК) і полісахариди. П. б. утворюють структурну основу всіх живих організмів; всі процеси в клітині пов'язані з взаємодіями П. б. між собою і з ін. молекулами. Серед останніх важливу роль відіграють л і p і д и, що утворюють біол. мембрани (див. Клітинні структури). Ліпіди не є полімерами, але мають недо-римі загальними з ними властивостями, зокрема здатністю утворювати жідкокрістал-лич. структури.
П. б. є високомолекулярними сполуками (мол. маса 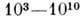 а. е. м)., до них застосовні всі закономірності, встановлені для ін. природних і синтетичні. полімерів . Однак особливості хім. будови приводять до появи у П. б. унікальною просторів, структури, незвичайних фіз., хім. і біол. властивостей. За будовою осн. ланцюга білки і НК однорідні, подібно г о-мополімерам, у яких брало все мономерні ланки ланцюга ідентичні. Але в послідовності бічних груп у П. б. закодована генетич. інформація організму, тому П. б. слід віднести до гетеропо-Лімер із заданою нерегулярної послідовник-ністю мономерних ланок. У структурі і властивостях П. б. відображені ці особливості їх хім. будови. Просторів. будова П. б. з определ. структурою всієї макромолекули зв. конформацией; від конформації залежить взаємодія П. б. з ін. молекулами. Наїб. важливі біол. ф-ції П. б. також визначаються його конформацией і здатністю змінювати її при разл. взаємодіях. У більшості випадків взаємодії П. б. є специфічно-м і, т. е. залежать від послідовності мономерних ланок і локальної структури (див. також біофізика ).
а. е. м)., до них застосовні всі закономірності, встановлені для ін. природних і синтетичні. полімерів . Однак особливості хім. будови приводять до появи у П. б. унікальною просторів, структури, незвичайних фіз., хім. і біол. властивостей. За будовою осн. ланцюга білки і НК однорідні, подібно г о-мополімерам, у яких брало все мономерні ланки ланцюга ідентичні. Але в послідовності бічних груп у П. б. закодована генетич. інформація організму, тому П. б. слід віднести до гетеропо-Лімер із заданою нерегулярної послідовник-ністю мономерних ланок. У структурі і властивостях П. б. відображені ці особливості їх хім. будови. Просторів. будова П. б. з определ. структурою всієї макромолекули зв. конформацией; від конформації залежить взаємодія П. б. з ін. молекулами. Наїб. важливі біол. ф-ції П. б. також визначаються його конформацией і здатністю змінювати її при разл. взаємодіях. У більшості випадків взаємодії П. б. є специфічно-м і, т. е. залежать від послідовності мономерних ланок і локальної структури (див. також біофізика ).
Розрізняють 4 рівня структурної організації П. б. Наїб. чітко вони виражені у білків. Первинна структура - це хім. будова молекули. Найчастіше під первинною структурою розуміють послідовність мономерних ланок П. б. У первинну структуру включаються хім. зв'язку між ланцюгами і всередині ланцюгів (між отд. ланками). Вторинна структура - спіральне розташування мономерних ланок у тих чи інших ділянках ланцюга П. б. Третинна структуrа - просторів. структура ланцюга, включаючи розташування елементів вторинної структури і зв'язують їх ділянок. Четвертичная структура - розташування відділення. ланцюгів (одиниць третинної структури) в утвореному ними комплексі.
Білки складаються з однієї або дек. поліпептидних ланцюгів, к-які з'єднані між собою хім. або міжмолекулярними зв'язками. Поліпептидні ланцюги побудовані з мономірних ланок - амінокислотних залишків 20 разл. сортів. Амінокислоти являють собою органічну. (Карбонові) кислоти, що містять 1 або 2 аміногрупи NH2. У нейтральному середовищі вони мають структуру,
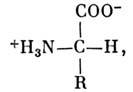
де R - бічна група, своя для кожної з 20 амінокислот. Амінокислоти є оптич. L-ізомерами (див. ізомерія молекул ). Число мономерних ланок, що входять в поліпептидні ланцюги, може змінюватися від дек. десятків до декількох. тисяч; поліпептиди з меншим числом ланок зв. олігопепті-д а м і. Кожен білок має потужність. розміри (мол. маса 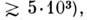 його індивідуальність визначається послідовністю амінокислотних залишків. За своїми ф-ціям білки діляться на каталітичні (ферменти, біол. Каталізатори хім. Реакцій), структурні, транспортні (гемоглобін), рецепторні, ре-гуляторние (гормони), захисні (антитіла) і ін. Залежно від складу виділяють прості білки - протеїни, що складаються тільки з амінокислот, і складні білки -протеіди, до складу яких брало поряд з амінокислотами входять вуглеводи (глікопротеїди), липида (ліпопротеїди), НК (нуклеопротеїни) і т. д. За формою розрізняють глобулярні білки, що утворюють щільні глобули, і фібрилярні білки, що утворюють довгі волокн або шари. Білки беруть участь в найважливіших генетич. і регуляторних процесах. Нек-риє структурні білки можуть утворювати агрегати у вигляді волокон, трубочок, оболонок. Іноді один і той же білок виконує дек. ф-ций.
його індивідуальність визначається послідовністю амінокислотних залишків. За своїми ф-ціям білки діляться на каталітичні (ферменти, біол. Каталізатори хім. Реакцій), структурні, транспортні (гемоглобін), рецепторні, ре-гуляторние (гормони), захисні (антитіла) і ін. Залежно від складу виділяють прості білки - протеїни, що складаються тільки з амінокислот, і складні білки -протеіди, до складу яких брало поряд з амінокислотами входять вуглеводи (глікопротеїди), липида (ліпопротеїди), НК (нуклеопротеїни) і т. д. За формою розрізняють глобулярні білки, що утворюють щільні глобули, і фібрилярні білки, що утворюють довгі волокн або шари. Білки беруть участь в найважливіших генетич. і регуляторних процесах. Нек-риє структурні білки можуть утворювати агрегати у вигляді волокон, трубочок, оболонок. Іноді один і той же білок виконує дек. ф-ций.
Первинна структура. Освіта полі-пептидного ланцюга із заданою послідовністю амінокислотних залишків відбувається в клітці всередині клітинного апарату - рибосоми. Приєднання кожної наступної ланки ланцюга відбувається з виділенням молекули води. Утвориться ланцюг має наступну структуру:
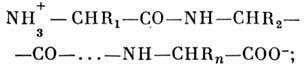
оскільки з'єднання мономерів відбувається за принципом "голова до хвоста", ланцюг потужність. чином спрямована: зліва знаходиться N-кінець ланцюга, праворуч - С-кінець. Амінокислотні залишки ланцюга в залежності від виду бічний групи R діляться на дек. типів. До неполярних, погано розчиняється у воді відносяться аланін, валін, лейцин, ізолейцин, фенілаланін, триптофан, тирозин, метіонін, гліцин і цістепін. Полярні і заряджені амінокислотні залишки мають гарну розчинність в воді. До полярним відносяться серії, треонін, аспарагін, пролін і глутамін. Заряджені аспарагінова і глутамінова к-ти (негативно), лізин і аргінін (позитивно). Можуть бути зарядженими також цистеїн і гістидин. В цілому молекула білка несе покладе. і отрицат. заряди . У первинну структуру білка міститься вся інформація, яка визначає його просторів. структуру і ф-ції. Визначення первинної структури поліпептидного ланцюга виробляють шляхом часткового розщеплення її на короткі перекриваються фрагменти з подальшим аналізом їх амінокислотної послідовності, починаючи з N-кінця. Це вдається зробити для не надто довгих послідовностей, тому структуру довгих поліпептидів знаходять, комбінуючи дані для фрагментів. Поліпептидний ланцюг має гнучкість за рахунок обертання навколо хім. зв'язків, утворених атомами С (чорні кульки на рис. 1, обертання зображено стрілками). Зв'язок між групами СО і NH зв. пептидного. Обертання навколо пептидного зв'язку утруднено, тому атоми H, N, С і О лежать в одній площині. Вторинна структура. Завдяки своїй гнучкості поліпептидні ланцюга здатні утворювати впорядковані структури із спіральною симетрією . найбільш поширені 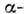 спіралі і
спіралі і 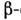 структури. a-Спіраль являє собою праву спіраль, у до-рій на один виток припадає 3,6 амінокислотних залишку; крок спіралі 5,4
структури. a-Спіраль являє собою праву спіраль, у до-рій на один виток припадає 3,6 амінокислотних залишку; крок спіралі 5,4 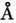 , діаметр
, діаметр 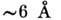 (Без бічних груп).
(Без бічних груп).
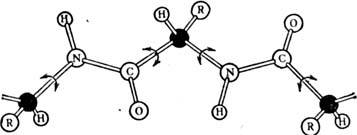
Мал. 1. Обертання пептидних груп.
Спіраль стабілізована водневими зв'язками між групами СО і NH разл. мономерних ланок, віддалених один від одного на відстані 4 залишків. Водневі зв'язки (пунктир на рис. 2, а) спрямовані уздовж осі спіралі, в цілому  спіраль являє собою досить жорстку структуру. Не всім амінокислотним залишкам енергетично вигідно освіту a - спіралі. Знання відповідних енергетичних. параметрів дозволяє прогнозувати ймовірність утворення a- спіралі в тій чи іншій ділянці білка. Існують b-шари двох типів: паралельні і антіпарал-лельно. На рис. 2, б показана структура антіпарал-лельного
спіраль являє собою досить жорстку структуру. Не всім амінокислотним залишкам енергетично вигідно освіту a - спіралі. Знання відповідних енергетичних. параметрів дозволяє прогнозувати ймовірність утворення a- спіралі в тій чи іншій ділянці білка. Існують b-шари двох типів: паралельні і антіпарал-лельно. На рис. 2, б показана структура антіпарал-лельного  шару. стабілізуючі
шару. стабілізуючі  шар водневі зв'язку між пептидними групами спрямовані поперек ланцюгів, а самі ланцюга витягнуті і утворюють складчасту структуру. У білку зустрічаються також т. Н.
шар водневі зв'язку між пептидними групами спрямовані поперек ланцюгів, а самі ланцюга витягнуті і утворюють складчасту структуру. У білку зустрічаються також т. Н.
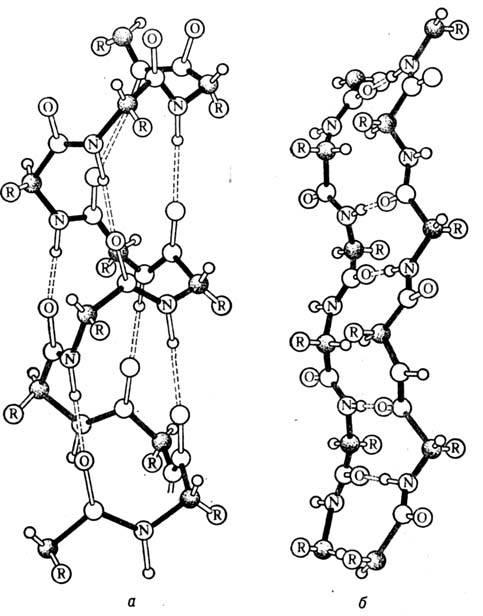
Мал. 2. Вторинна структура білків: а - a-спіраль; б - b-структура.
b- вигини, що забезпечують поворот ланцюга приблизно на 180  при утворенні водневого зв'язку. Можливі й ін. Типи спіралей. Всі названі вторинні структури характерні для глобулярних білків. Фібрилярний білок, з к-якого будуються довгі орієнтирів. волокна, утворює спіралі іншого виду. Вторинну (і третинну) структуру білка досліджують за допомогою рентгенівського структурного аналізу , Що дозволяє визначити положення всіх атомів в молекулі. Труднощі тут пов'язані з тим, що не кожен білок можна отримати у вигляді кристалів необхідного розміру. Зазвичай структура білка в розчині мало відрізняється від структури в кристалі, це пов'язано з тим, що кристали білка містять багато води. Однак в цілому питання про відповідність структури білка в розчині і в кристалі залишається відкритим. Содержаніеa- і b-структур сильно розрізняється для разл. білків.
при утворенні водневого зв'язку. Можливі й ін. Типи спіралей. Всі названі вторинні структури характерні для глобулярних білків. Фібрилярний білок, з к-якого будуються довгі орієнтирів. волокна, утворює спіралі іншого виду. Вторинну (і третинну) структуру білка досліджують за допомогою рентгенівського структурного аналізу , Що дозволяє визначити положення всіх атомів в молекулі. Труднощі тут пов'язані з тим, що не кожен білок можна отримати у вигляді кристалів необхідного розміру. Зазвичай структура білка в розчині мало відрізняється від структури в кристалі, це пов'язано з тим, що кристали білка містять багато води. Однак в цілому питання про відповідність структури білка в розчині і в кристалі залишається відкритим. Содержаніеa- і b-структур сильно розрізняється для разл. білків.
Третинна структура. Більшість глобулярних білків знаходиться в водно-сольовий середовищі. Укладання елементів вторинної структури при цьому така, що гідрофільні (Полярні, заряджені) амінокислотні залишки розташовуються в осн. на поверхні глобули, а неполярні, погано розчинні у воді (гідрофобні) амінокислотні залишки - у внутр. частини глобули. При цьому кулька набуває унікальну (ідентичну для всіх молекул даного білка) компактну і стабільну форму.
Найчастіше внутр. частина глобули утворена b-шару-ми, а зовнішня -  спіралями. Встановлено закономірність в амінокислотноїпослідовності в цих
спіралями. Встановлено закономірність в амінокислотноїпослідовності в цих  спіралях: кожне 3-е або 4-е положення уздовж ланцюга займають неполярні амінокислотні залишки. При цьому на бічній поверхні циліндра, до-рим можна уявити
спіралях: кожне 3-е або 4-е положення уздовж ланцюга займають неполярні амінокислотні залишки. При цьому на бічній поверхні циліндра, до-рим можна уявити  спіраль, утворюється неполярная смуга, паралельна її осі. Саме ця гидрофобная смуга звернена всередину глобули і контактує з її гідрофобною частиною.
спіраль, утворюється неполярная смуга, паралельна її осі. Саме ця гидрофобная смуга звернена всередину глобули і контактує з її гідрофобною частиною.
Виняток становлять мембранні білки, які контактують з неполярной жирної внутр. частиною ліпідної мембрани. На поверхні білка в цьому випадку знаходяться гідрофобні амінокислотні залишки.
Ще одна важлива закономірність просторів. структури білків - доменне будова. Часто єдина полі-пептидний ланцюг утворює не одну глобулу, а дек. компактних областей, розташованих потужність. чином в просторі. Кожна така область (домен) формується з  спіралей,
спіралей,  шарів і ін. елементів вторинної структури. В цьому випадку можна говорити як про третинної структурі таких доменів, так і про третинної структурі білків в цілому, розуміючи під цим взаємне розташування доменів в просторі. Прикладом домену, що міститься у мн. білках, є блок з двох
шарів і ін. елементів вторинної структури. В цьому випадку можна говорити як про третинної структурі таких доменів, так і про третинної структурі білків в цілому, розуміючи під цим взаємне розташування доменів в просторі. Прикладом домену, що міститься у мн. білках, є блок з двох  шарів, з'єднаних між собою
шарів, з'єднаних між собою 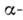 спіральним сегментом. Доменна структура білків важлива для їх біол. ф-ций. Ймовірно також, що домени - це елементарні білки, на основі яких брало в ході еволюції виникає різноманітність білкових структур.
спіральним сегментом. Доменна структура білків важлива для їх біол. ф-ций. Ймовірно також, що домени - це елементарні білки, на основі яких брало в ході еволюції виникає різноманітність білкових структур.
Четвертичная структура. У тих випадках, коли глобулярний білок складається з дек. субодиниць, не пов'язаних між собою хім. зв'язками, говорять про його четвертинної структурі. Зв'язок субодиниць між собою здійснюється гл. обр. за рахунок гідрофобних взаємодій; при цьому на контактують частинах поверхні субодиниць розташовані в осн. гідрофобні амінокислотні залишки. Іноді у взаємодію між субодиницями глобулярних білків дають помітний внесок водневі зв'язку. Др. тип четвертинних структур представляють білки, що утворюють нитки цитоскелета. Цитоскелет заповнює простір між ядром і внутр. поверхнею клітинної мембрани і виконує ряд важливих ф-ций, визначаючи форму клітини, її переміщення як цілого, розміщення і транспорт внутр. компонентів. Відомі три типи таких ниток: мікрофіламенти, мікротрубочки і проміжні філаменти. Детально вивчені перші два типи. Мікрофіламенти збираються з молекул глобулярного білка актину, з'єднуючись в довгі ланцюги, що утворюють подвійні спіралі. Микротрубочки також збираються з глобулярних молекул білка тубуліну і є важливим компонентом мі-тотіч. апарату (апарату ділення) клітини, що створює т. н. мітотіч. Веретнов і визначальним розподіл генетич. матеріалу між дочірніми клітинами.
Особливий тип структур представляють фібрилярні білки актин і міозин, що утворюють впорядковані структури (саркомеров). Їх ковзання одна відносно одної становить основу механізму м'язового скорочення. У складні просторів. структури збираються білки оболонок вірусів, бактеріофагів і таких структур, як рибосоми, нуклеосоми і ін.
Вищі структури білків - це стану, що володіють відносить. мінімумом вільної енергії. Вони стійкі в физиологич. умовах, можуть змінюватися лише в определ. межах. Наїб. стійка первинна структура білків, інші легко руйнуються при зовн. впливах. Таке руйнування зв. денатурацією і, як правило, призводить до втрати біол. властивостей.
Нуклеїнові кислоти. Дезоксирибонуклеїнові кислоти (ДНК) і РНК (РНК) є полинуклеотидами, т. Е. П.Б., мономірними ланками до яких служать нуклеотиди. Нуклеотиди складаються з азотистої основи, залишків фосфорної к-ти і вуглеводу (рибози або дезокси-рибози). ДНК є хранителем генетичної. інформації організму, записаної у вигляді послідовності 4 сортів її мономерних ланок. Ця інформація переписується (транскрибується) при синтезі інформаці. (Матричної) РНК (мРНК), а потім за допомогою генетичної. коду перекладається (транслюється) в амінокислотну послідовність білків. Др. види РНК виконують роль переносників амінокислот (транспортні РНК - тРНК) або складають структурну основу рибосом (Хвороби - рРНК). Молекули РНК в деяких випадках можуть мати також каталитич. активністю, подібної активності білків-ферментів (т. н. рибозими).
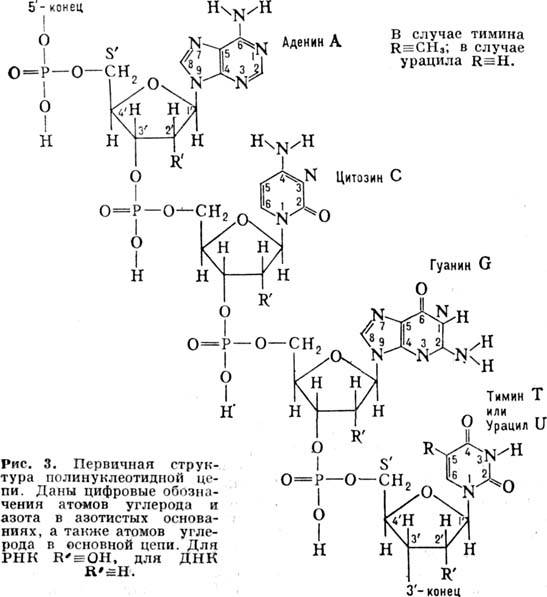
Первинна структура НК. Полінуклео-тідная ланцюг (рис. 3) складається з сахарофосфатнимі остова (в нього входить дезоксирибоза в разі ДНК і рибоза в разі РНК), к-рому приєднані плоскі бічні групи - азотисті основи (аденін А, цитозин С, гуанін G і тимін Т в разі ДНК; А, С, G і урацил U в разі РНК). У клітці такі ланцюга синтезуються за допомогою спец. ферментів на матріце- молекулах ДНК; існує і процес синтезу ДНК на РНК-матриці, здійснюваний ін. ферментом (зворотного транскриптазой). Полінуклео-тідная ланцюг має напрямок, яке визначається тим, що 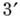 -і атом З одного мономера з'єднується фос-фодіефірной зв'язком з
-і атом З одного мономера з'єднується фос-фодіефірной зв'язком з 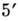 -м атомом С наступного мономера. Кожна мономерна група ланцюга ионизована p несе один отрицат. заряд. Розміри молекул РНК і ДНК змінюються в широких межах. Транспортні РНК (найкоротші молекули РНК) складаються з 75-84 нуклеотидів; довжина гетерогенних ядерних РНК досягає
-м атомом С наступного мономера. Кожна мономерна група ланцюга ионизована p несе один отрицат. заряд. Розміри молекул РНК і ДНК змінюються в широких межах. Транспортні РНК (найкоротші молекули РНК) складаються з 75-84 нуклеотидів; довжина гетерогенних ядерних РНК досягає 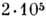 нуклеотидів. Короткі ДНК містять зазвичай дек. тисяч пар нуклеотидів, але існують ДНК, к-які містять їх
нуклеотидів. Короткі ДНК містять зазвичай дек. тисяч пар нуклеотидів, але існують ДНК, к-які містять їх 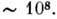
Вторинна структура ДНК. Осн. принцип утворення вторинних структур полинуклеотидов - т. зв. комплементарне спаровування азотистих основ.
Воно призводить до утворення подвійних і потрійних гвинтових структур (спіралей), що стабілізується водневими зв'язками між азотистими підставами різних ланцюгів н межплоскостним взаємодіями азотистих основ. Осн. вторинна структура ДНК (B-форма), що представляє собою праву подвійну спіраль, запропонована в 1953 Дж. Уотсоном (J. Watson) і Ф. Криком (F. Crick). У цій структурі дві комплементарні ланцюжка антіпараллельни. Проти кожного А одного ланцюга розташований Т інший, проти G розташований С (у дво-Стек гілок РНК А злучається з U). При цьому утворюються енергетично вигідні водневі зв'язку: 2 в AT-парі і 3 в GC-парe; відстань між точками приєднання підстав до цукру виявляється однаковим для А Т - і GC-паp (рис. 4). Сахарофосфатнимі ланцюга утворюють при цьому гладкі гвинтові лінії. Площині підстав в 5-формі ДНК складають з віссю подвійної спіралі прямий кут. На виток подвійної спіралі доводиться в натрієвої солі ДНК при високій вологості 10 пар основ. Відстань між площинами сусідніх пар основ становить 3,4 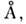 що оптимально для міжплощинних взаємодій, що вносять наиб. енергетичних. внесок в стабільність подвійної спіралі. У розчині на виток подвійної спіралі в B-формі доводиться 10,5 пари підстав. Діаметр подвійної спіралі дорівнює приблизно 22
що оптимально для міжплощинних взаємодій, що вносять наиб. енергетичних. внесок в стабільність подвійної спіралі. У розчині на виток подвійної спіралі в B-формі доводиться 10,5 пари підстав. Діаметр подвійної спіралі дорівнює приблизно 22 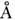 . В-форма характерна для натрієвої солі ДНК. При зміні зовн. умов (темп-ри, іонного складу середовища) параметри подвійної спіралі в В -форме змінюються, тому слід говорити про 5-сімействі структур. До цього сімейства відноситься і літієва сіль ДНК, т. Н. З-форма, в якій на виток подвійної спіралі доводиться 9,3 пари підстав, площину підстав відхилена на
. В-форма характерна для натрієвої солі ДНК. При зміні зовн. умов (темп-ри, іонного складу середовища) параметри подвійної спіралі в В -форме змінюються, тому слід говорити про 5-сімействі структур. До цього сімейства відноситься і літієва сіль ДНК, т. Н. З-форма, в якій на виток подвійної спіралі доводиться 9,3 пари підстав, площину підстав відхилена на 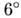 від площини, перпендикулярної до осі спіралі.
від площини, перпендикулярної до осі спіралі.
У натрієвої солі ДНК при відносить. вологості нижче 75% відбувається кооперативний різкий перехід ДНК з В - в Л-форму. Л-форма (точніше А - сімейство форм) - це також права подвійна спіраль, але з ін. Параметрами, ніж у B-форми. Площині підстав сильно відхилені від площини, перпендикулярної до осі спіралі, а самі пари комплементарних основ зміщені від осі подвійної спіралі до її периферії, тому при спостереженні вздовж осі молекула в А -форме представляється порожнистої трубкою. РНК існує тільки в A-формі, як і гібриди ДНК - РНК. Характерна для двунітевой РНК структура містить 11 пар основ на виток подвійної спіралі, а відхилення площині підстав від площини, перпендикулярної до ОСП, становить 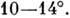 B-форма - осн. структура ДНК в живій клітині. ДНК може існувати і в ін. Формі, у вигляді Z-спіралі. Рентген-ноструктурний аналіз дозволив, як і в випадку білків, встановити з високою роздільною здатністю просторів. структури полинуклеотидов з разл. послідовностями нуклеотидів. Z-форма ДНК, що отримала свою назв. в зв'язку з зигзагоподібним будовою сахарофосфатнимі остова, являє собою ліву подвійну спіраль з періодом
B-форма - осн. структура ДНК в живій клітині. ДНК може існувати і в ін. Формі, у вигляді Z-спіралі. Рентген-ноструктурний аналіз дозволив, як і в випадку білків, встановити з високою роздільною здатністю просторів. структури полинуклеотидов з разл. послідовностями нуклеотидів. Z-форма ДНК, що отримала свою назв. в зв'язку з зигзагоподібним будовою сахарофосфатнимі остова, являє собою ліву подвійну спіраль з періодом 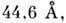 що містить 12 пар основ на виток і освічену антипаралельними полінуклеотидні ланцюгами, спареними за правилами комплементарності. Повторюваним ланкою в ній є не одна пара нуклеотидів, а дві. Наїб. легко в Z-форму переходять регулярно чергуються послідовності пуринів-вих і піримідинових нуклеотидів. У физиологич. умовах Z-форма в лінійних ДНК не спостерігалася. Однак в кільцевих молекулах ДНК може відбуватися перехід від. ділянок молекули в Z-форму. На рис. 5 наведені об'ємні моделі ДНК в В - і Z-формах.
що містить 12 пар основ на виток і освічену антипаралельними полінуклеотидні ланцюгами, спареними за правилами комплементарності. Повторюваним ланкою в ній є не одна пара нуклеотидів, а дві. Наїб. легко в Z-форму переходять регулярно чергуються послідовності пуринів-вих і піримідинових нуклеотидів. У физиологич. умовах Z-форма в лінійних ДНК не спостерігалася. Однак в кільцевих молекулах ДНК може відбуватися перехід від. ділянок молекули в Z-форму. На рис. 5 наведені об'ємні моделі ДНК в В - і Z-формах.
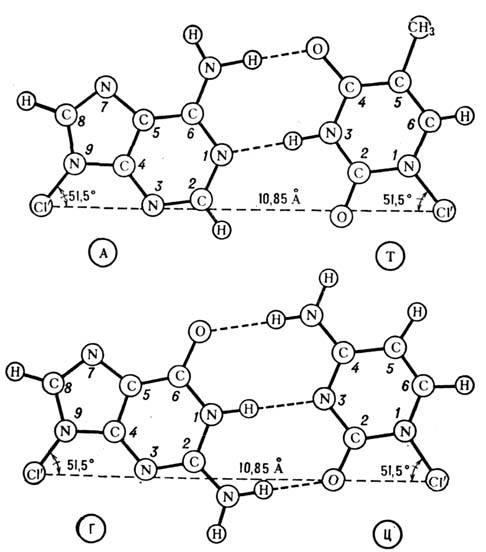
Мал. 4. Уотсон-криковських пари підстав (жирним пунктиром позначені водневі зв'язку).
Подвійна спіраль ДНК в B-формі є порівняно жорсткою молекулою. Її макромолекулярні властивості в розчині добре описуються моделлю гнучкого пружного стрижня, що здійснює тепловий рух. Згинальна жорсткість ДНК в А-формі більше, ніж в В-формі, причому вона анізотропна: молекула в кожній точці легше згинається в напрямку жолобів подвійної спіралі, ніж в перпендикулярному напрямку.
Вторинна і третинна структури РНК. Молекули РНК зустрічаються переважно. у вигляді одиночних ниток, в яких брало утворюються двунітевие шпильки за рахунок спарювання підстав комплементарних ділянок нитки. Однонітевиє ділянки можуть утворювати водневі зв'язки з ін. Однониткових ділянками, визначаючи третинну структуру молекули. Третинна структура добре вивчена для молекули тРНК; якщо по вторинній структурі тРНК нагадує лист конюшини, то в просторі вона приймає форму літери Г. Вторинна структура фенілаланіновой тРНК, близька до A-формі, містить 20 пар основ, між якими утворені 52 водневі зв'язку. Третинна структура містить ще кілька. дес. таких зв'язків за участю азотистих основ і сахарофосфатнимі ланцюгів. Всі види тРНК мають схожу третинну структуру. Третинна структура ДНК. В вірусних частинках ДНК компактно упакована, проте дані про вид цієї упаковки відсутні. Краще відома упаковка ДНК в хромосомах еукаріотіч. клітин (див. Клітинні структури). ДНК вірусів, бактеріофагів, плазмід і бактерій зазвичай представляють собою кільця, утворені замкнутими подвійними спіралями (кожна з ниток замкнута на себе). Хромосомна ДНК в еукаріотіч. клітинах також утворює петлі, топологічно еквівалентні замкнутим кільцям. Кільцева ДНК зазвичай сверхспіралізована і утворює просторів. сверхвіткі, к-які також можна розглядати як елементи третинної структури ДНК. У разл. умовах і в залежності від послідовності нуклеотидів, ДНК може утворювати і ін. види вторинної і третинної структур (паралельні спіралі, потрійні і четвертні спіралі і ін.).
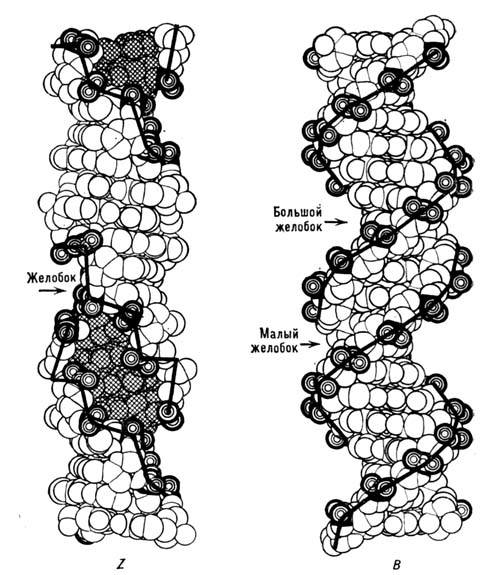
Мал. 5. Об'ємні моделі ДНК в В- і Z-формах (жирною лінією позначений сахарофосфатний остов).
Полісахариди є П. б., Побудованими з мо-носахарідних залишків. Прикладами лінійних гомо-полісахаридів є амилоза (складова частина крохмалю) і целюлоза (осн. Частина деревини). Мономером амілози і целюлози є глюкоза. Др. приклад лінійного гомополісахаридів - хітин, з к-якого побудовані панцири комах. Мономірним ланкою лінійного полісахариду може бути і дисахарид. Первинна структура полісахариду, як правило, регулярна, але існують полісахариди з нерегулярною послідовністю разл. мономерних ланок. Крім лінійних існують полісахариди з розгалуженою первинною структурою. Лінійні полісахариди утворюють жорсткі вторинні структури (одно-, дво- і трьох-Стек гілок спіралі). Більш високі структури можуть бути як волокнистими, так і гелеобразную. Якщо однорідність полисахаридной ланцюга порушена встраиванием ін. Сахаридов або ветвлениями, полісахариди можуть утворювати гнучкі волокна або гелі. Полісахариди можуть утворювати комплекси з білками і ліпідами, вони надають жорсткість і міцність стінок клітин рослин і бактерій. Стінки тваринної клітини не мають ці св-вами і містять в клітинній мембрані лише недо-рої кількість олігосахаридів (коротких полісахаридів), пов'язаних з білками, т. Н. Глік-протеидов.
Дослідження структури і властивостей П. б. виробляють разл. фіз. і фіз - хім. методами. Сюди відносяться рентгеноструктурний аналіз та електронна мікроскопія, методи ЯМР і ЕПР, дифузне розсіювання рентген. променів, оптич. методи (дослідження спектрів поглинання, оптич. активності, люмінесценції і ін.), мікрокалориметрія, гидродинамич. методи, хроматографія, електрофорез, полярографія та ін. Вивчення фотохім. і радиац - хім. змін в П. б. служить для дослідження їх структури і для дослідження механізму дії УФ-та іонізуючого випромінювань на ці об'єкти. П. б. є діелектриками і поліелектролітами, тому важливі вимірювання діелектричної. поляризації і втрат в широкому діапазоні частот. Особливий інтерес представляє дослідження кон-формації. перетворень П. б. в розчині, з цією метою використовують спектрофотометрію в УФ-області і вимірювання кругового дихроїзму . У поліпептидах при утворенні з безладного клубка впорядкованої спіральної структури в області довжин хвиль 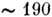 нм спостерігається сильний гіпохромний ефект (зменшення поглинання), придатний для визначення ступеня спи-ральності. Ароматичні амінокислотні залишки мають смуги поглинання в області
нм спостерігається сильний гіпохромний ефект (зменшення поглинання), придатний для визначення ступеня спи-ральності. Ароматичні амінокислотні залишки мають смуги поглинання в області 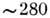 нм, що змінюються при зміні оточення (неполярного на полярне), що дозволяє судити про розташування і контактах цих залишків в молекулі білка. Міжплощинні взаємодії в НК обумовлює гіпохромний ефект в області
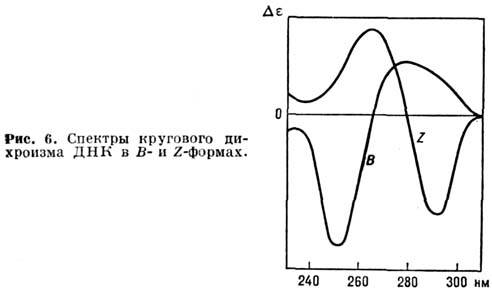
нм, що змінюються при зміні оточення (неполярного на полярне), що дозволяє судити про розташування і контактах цих залишків в молекулі білка. Міжплощинні взаємодії в НК обумовлює гіпохромний ефект в області 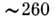 нм. Відповідно при руйнуванні подвійної спіралі (переході спіраль - клубок) спостерігається збільшення поглинання на 40%. Приріст поглинання пропорційний частці нуклеотидів, які перейшли з впорядкованої спіральної структури в невпорядкований клубок. П. б. мають оптич. активністю, властивої всім амінокислотам (крім гліцину) і, відповідно, поліпептидам і білків. Наїб. інформативні вимірювання кругового дихроизма , К-рий залежить від конформації полімеру. На рис. 6 наведені криві кругового дихроїзму для ДНК в b- і Z-форма.
нм. Відповідно при руйнуванні подвійної спіралі (переході спіраль - клубок) спостерігається збільшення поглинання на 40%. Приріст поглинання пропорційний частці нуклеотидів, які перейшли з впорядкованої спіральної структури в невпорядкований клубок. П. б. мають оптич. активністю, властивої всім амінокислотам (крім гліцину) і, відповідно, поліпептидам і білків. Наїб. інформативні вимірювання кругового дихроизма , К-рий залежить від конформації полімеру. На рис. 6 наведені криві кругового дихроїзму для ДНК в b- і Z-форма.
Переходи спіраль - клубок в П. б. Поліпептидні ланцюги, що утворюють в определ. умовах впорядковані спіральні структури, при зміні зовн. умов переходять у стан невпорядкованого клубка. Ці конформації. переходи наиб. детально вивчені на СПН-тотіч. гомогенних поліпептидах. Перехід a-спіраль - клубок носить кооперативний характер і характеризується порівняно вузьким інтервалом переходу. Коопе-тивно переходу зумовлена невигідністю звільнення з спіральної структури ( плавлення ) Коротких ділянок, т. К. При цьому витрачається значить. енергія на розрив водневих зв'язків, а виграш в ентропії за рахунок появи рухливості пептидних ланок малий. При плавленні довгих ділянок спіралі можлива компенсація енергетичних. витрат. Процес денатурації білків при зміні зовн. умов включає в себе і перехід спіраль - клубок, але зазвичай процес є багатостадійним. Від. стадії можуть носити кооперативний характер. Вивчення проміжних стадій і кінетики прямого і зворотного процесів (ренатурації) є джерелом відомостей про самоорганізацію вищих структур білкових глобул. Подвійна спіраль ДНК може руйнуватися при зміні зовн. умов, молекула при цьому переходить в стан одного або двох безладних клубків (при повному поділі ниток). Цей перехід, також зв. переходом спіраль - клубок або внутрімолекулярних плавленням, вивчений експериментально і теоретично для b-форми ДНК. Перехід спіраль - клубок розглядають на основі одновимірної Ізинга моделі .
В рамках моделі пояснюються всі спостережувані на досвіді закономірності переходу в ДНК. Перехід спіраль - клубок в ДНК аналогічний фазового переходу 1-го роду, але не є істинним фазовим переходом, т. К. Молекулу можна розглядати як одновимірну систему. Інтервал переходу (напр., Інтервал темп-р переходу) кінцевий. У цьому інтервалі молекула розбивається на чергуються спіральні і клубкообразние ділянки. Т. к. Локальне або повне розділення ниток подвійної спіралі ДНК відбувається при мн. генетич. процесах в клітці, причому в цьому процесі беруть участь ін. молекули, які взаємодіють з ДНК, теорія переходу спіраль - клубок, що включає питання про вплив ін. молекул ( "теорію скріпок"), важлива для розуміння механізму функціонування ДНК.
ДНК в клітині має отрицат. сверхспіралізаціі, т. е. подвійна спіраль в ній кілька розкручена (в кільцевих ДНК при цьому подвійна спіраль утворює витки сверхспіралі). У клітці є система ферментів (топоізомераз), що змінюють сверхспі-ралізації. Широко поширена лише отрицат. сверхспіралізаціі. Сверхспіральная ДНК володіє покращення. енергією; топоізомерази витрачають енергію на створення сверхспіралізаціі. Мірою сверхспіраліза-ції є щільність сверхвітков s (число сверхвітков, що припадає на один виток подвійної спіралі). Величина s негативна, нижче мається на увазі її абс. значення. З ростом s молекула ДНК стає більш рухомий, реакционноспособной, збільшується ймовірність порушень структури подвійної спіралі (локальних її розкриттів), в отд. областях молекули при досить великому значенні s виникають альтернативні (т. е. відмінні від 5-форми) структури - хрестоподібні структури, Z - і Н - форми і ін. Всі ці структури не утворюються в лінійної ДНК в стандартних умовах. Енергія, необхідна для їх освіти, черпається з енергії сверхспіралізаціі. Для дослідження альтернативних структур ДНК і визначення їх енергетичних. параметрів використовують експерименти, аналізовані за допомогою топологіч. теорії. Топологіч. обмеження, що накладаються кільцевих замкнутим будовою, призводять і до ін. змін структури і фіз. властивостей молекул ДНК. Дослідження впливу топологіч. ефектів на будову і властивості ДНК і її біол. ф-ції, на регуляцію генетич. процесів є одним із завдань молекулярної біофізики. Літ .: Аккерман Ю., Біофізика, пров. з англ., М., 1964; Фізичні методи дослідження білків і нуклеїнових кислот, М., 1967; Веденов А. А., Дихне А. М., Франк-Каменецький М. Д., Перехід спіраль - клубок в ДНК, "УФН", 1971, т. 105, ст. 3, с. 479; Б л ю м е н-фельд Л. А., Проблеми біологічної фізики, 2 вид., М., 1977; Шабарова 3. А., Богданов А. А., Хімія нуклеїнових кислот і їх компонентів, М., 1978; Л а-зуркін Ю. С., Молекулярне плавлення ДНК і ефект тонкої структури кривих плавлення, "Молекулярна біологія", 1977, т. 11, ст. 6, с. 1311; Волькенштейн М. В., Біофізика, 2 вид., М., 1988 ,; Франк-Каменецький М. Д., Вологодський А. В., Топологічні аспекти фізики полімерів: теорія і її біофізичні додатки, "УФН", 1981, т. 134, ст. 4, с. 641; Кантор Ч., Шіммель П., Біофізична хімія, пер. з англ., т. 1-3, М., 1984-85; "У світі науки", 1985, ст. 12 (тематич. Вип.); Молекулярна біологія клітини, пров. е англ., т. 1-5, М., 1986-87; Вологодський А. В., Топологія і фізичні властивості кільцевих ДНК, М., 1988. Ю. С. Лазуркін.
покажчик >>