теплоємність
Теплоємність, кількість теплоти, що витрачається для зміни температури на 1 ° С. Згідно з більш суворому визначенню, теплоємність - термодинамічна величина, яка визначається виразом:
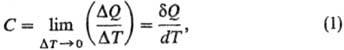
де Δ Q - кількість теплоти, повідомлене системі і яка викликала зміна її температури на Delta; T. Ставлення кінцевих різниць Δ Q / Т називається середньої теплоємності, ставлення нескінченно малих величин d Q / dT - істинної теплоємності. Оскільки d Q не є повним диференціалом функції стану, то і теплоємність залежить від шляху переходу між двома станами системи. Розрізняють теплоємність системи в цілому (Дж / К), питому теплоємність [Дж / (г · К)], молярна теплоємність [Дж / (моль · К)]. У всіх нижче наведених формулах використані молярні величини теплоємності.
з другого закону термодинаміки випливає, що теплоємність пропорційна похідною від ентропії системи S по температурі Т при сталості зовнішньої сили або термодинамічної координати (позначається індексом z):

Найбільш важливими видами теплоємності є теплоємність CV при постійному обсязі V і теплоємність Ср при постійному тиску р:
СV = (∂U / ∂T) V = T (∂S / ∂T) V, Ср = (∂Н / ∂Т) р = Т (∂S / ∂Т) р,
де U - внутрішня енергія, H - ентальпія системи. Значення Ср і СV пов'язані співвідношенням:
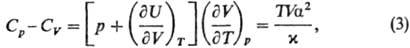
де a = V -1 (∂ V / ∂ Т) р - коефіцієнт термічного розширення, x = - V -1 (∂ V / ∂р) T - коефіцієнт ізотермічної стисливості . Оскільки за умовами стійкості фаз Ср, CV> 0 і (∂ V / ∂р) T <0, то згідно (3) Ср> CV. Це природно, тому що при ізобаріческом нагріванні частина тепла, крім збільшення внутрішньої енергії системи, йде на роботу розширення. для ідеальних газів (∂ U / ∂V) T = 0 і облік рівняння стану pV = RT приводить до співвідношення: Сp-CV = R (R - газова постійна). Для адіабатичного процесу С = 0.
теплоємність газів
Обчислення теплоємності зводиться до обчислення середньої енергії теплового руху окремих молекул, яке складається з поступальних і обертальних рухів молекули як цілого і з коливань атомів всередині молекули. Молярна теплоємність одноатомного газу дорівнює 3 R / 2 (по R / 2 на кожну ступінь поступального руху молекули). теплоємність багатоатомного газу в загальному випадку може бути представлена сумою вкладів від окремих видів руху - поступального, обертального, коливального.
Поступальна теплоємність розраховується так само, як для одноатомного газу. Обертальна і особливо коливальна теплоємності повинні, як правило, обчислюватися на основі квантової статистики. Відповідно до класичної статистикою, вклади в молярна теплоємність в розрахунку на одну ступінь свободи рівні: для обертального руху R / 2, для коливального руху R. Для більшості молекул при низьких і середніх температурах коливальні ступені свободи виродилися і не дають вкладу в теплоємність Наприклад, теплоємність двухатомного газу при звичайних температурах дорівнює 5 R / 2. Лише при досить високих температурах збуджуються коливання певної частоти.
Теплоємність твердих тіл
При низьких температурах теплоємність одноатомних кристалів пропорційна кубу абсолютної температури (закон Дебая): СV ~ Т 3. При високих температурах СV прагне до граничного значення 3 R, який визначається класичною теорією і не залежить від природи атомів (Правило Дюлонга і Пті). Значення 3 R може, однак, не досягатися, якщо раніше відбувається плавлення речовини або його розкладання. Методами квантової статистики доводиться рівність нулю теплоємності будь-якого тіла при абсолютному нулі температури (CV: 0 при Т: 0). Якби це було не так, ентропія системи, згідно (2), повинна була б звертатися в -, при T: 0, що суперечить третьому початку термодинаміки (див. теплова теорема ). Граничне значення СV = 3 R досягається вже при звичайних температурах у металів. Для деяких простих з'єднань з числом атомів в молекулі n граничне значення CV = 3nR [NaCl, MnS (n = 2), РbСl2 (n = 3) і ін.].
Для кристалічних твердих тіл існує характеристична температура q D, названа температурою Дебая, що розділяє "классічесскую область" температур Т 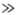 q D, в якій теплоємність описується законом Дюлонга і Пті, і "квантову область" T
q D, в якій теплоємність описується законом Дюлонга і Пті, і "квантову область" T 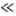 q D. Температура Дебая пов'язана з граничною частотою коливань атомів в кристалічній решітці і залежить від пружних постійних речовини (див. табл.).
q D. Температура Дебая пов'язана з граничною частотою коливань атомів в кристалічній решітці і залежить від пружних постійних речовини (див. табл.).
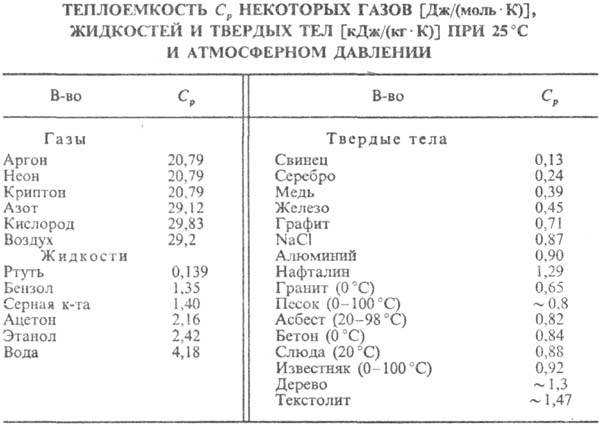
У металів внесок в значення СV дають електрони провідності (електронна теплоємність). Ця частина теплоємності може бути обчислена на основі квантової статистики Фермі, якій підпорядковуються електрони. Електронна теплоємність пропорційна температурі в першого ступеня, проте її внесок пренебрежимо малий при температурах, коли велика "решеточная" теплоємність (пропорційна T 3). антиферомагнетики і феримагнетики , Що володіють упорядкованим розташуванням спінових магнітних моментів атомів, мають додаткову магнітну складову теплоємності, яка відчуває різкий підйом при температурі фазового переходу речовини в парамагнітний стан (див. Кюрі точка ).
Методи визначення теплоємність індивідуальних речовин
Основним експериментальним методом є калориметрия . Теоретичний розрахунок теплоємності речовин здійснюється методами статистичної термодинаміки , Але він можливий тільки для порівняно простих молекул в стані ідеального газу і для кристалів, причому в обох випадках для розрахунку потрібні експериментальні дані про будову речовини.
Емпіричні методи визначення теплоємності речовин в стані ідеального газу засновані на уявленні про аддитивности вкладів окремих груп атомів або хімічних зв'язків. Опубліковані великі таблиці групових атомних вкладів в значення Пор. Для рідин, крім адитивно-групових, застосовують методи, засновані на відповідних станів законі , А також на використанні термодинамічних циклів, що дозволяють перейти до теплоємності рідини від теплоємності ідеального газу через температурну похідну ентальпії випаровування.
Для розчину обчислення теплоємності як адитивної функції теплоемкостей компонентів в загальному випадку некоректно, тому що надлишкова теплоємність розчину, як правило, значна. Для її оцінки потрібне залучення молекулярно-статистичної теорії розчинів (див. розчини неелектролітів ). Експериментально надлишкова теплоємність може бути визначена по температурної залежності ентальпії змішування, після чого можливий розрахунок Ср розчину.
Теплоємність гетерогенних систем представляє найбільш складний випадок для термодинамічної аналізу. на діаграмі стану переміщення уздовж кривої рівноваги фаз супроводжується зміною і р, і T / Якщо в процесі нагрівання відбувається зміщення точки фазового рівноваги, то це дає додатковий внесок в теплоємність, тому теплоємність гетерогенної системи не дорівнює сумі теплоемкостей складових її фаз, але перевершує її. На фазовій діаграмі при переході від гомогенного стану до області існування гетерогенної системи теплоємність відчуває стрибок (див. фазові переходи ).
Практичне значення досліджень теплоємності важливо для розрахунків енергетичних балансів процесів в хімічних реакторах і ін. Апаратах хімічного виробництва, а також для вибору оптимальних теплоносіїв. Експериментальне вимір теплоємності для різних інтервалів температур - від гранично низьких до високих - є основним методом визначення термодинамічних властивостей речовин. Для розрахунку ентальпій і ентропії речовини (в інтервалах від 0 до Т) використовують інтеграли від теплоємності:
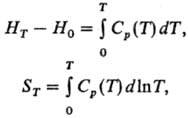
до яких додаються відповідні ефекти фазових переходів. Знання теплоємності реагентів в деякому інтервалі температур дозволяє здійснити розрахунок теплового ефекту реакції (див. Кирхгофа рівняння ), А знання теплоємність розчинів - розрахувати їх термодинамічні властивості при будь-якій температурі в межах дослідженого інтервалу.
Особливо слід підкреслити роль теплоємності в структурних дослідженнях індивідуальних речовин в конденсованому стані і розчинів. Величини, що є другою похідною потенціалів Гіббса або Гельмгольца за параметрами стану (а теплоємність відноситься до таких), дуже чутливі до структурних змін системи. У твердих тілах і сплавах при фазових переходах 2-го роду типу порядок - безладдя спостерігаються l-образні скачки теплоємності. У рідинах такі скачки мають місце поблизу критичних точок рівноваги рідина-газ і рідина-рідина (див. критичні явища ). У рідини, наприклад, при нагріванні частина енергії може йти не на порушення нових ступенів свободи молекул, а на зміну потенційної енергії взаємодіючих молекул. Цей внесок називається "конфигурационной" теплоємністю; вона пов'язана з характером молекулярного впорядкування в рідинах і розчинах. У біохімії політермічні вимірювання теплоємності дають інформацію про структурні переходах в білках.
Літ .: Рід Р., Праусніц Дж., Шервуд Т., Властивості газів і рідин, пер. з англ., 3 вид., Л., 1982; Шульц М.М., Філіппов В.К., "Ж. Всес. Хім. Т-ва ім. Д. І. Менделєєва", 1982, т. 27, с. 485-94; Панов М.Ю., Бєлоусов В.П., в сб .: Хімія і термодинаміка розчинів, в. 5, Л., 1982, с. 56-87; Термодинамічні властивості індивідуальних речовин, під ред. В.П.Глушко, 3 вид., Т. 1-4, М., 1978-82; Experimental thermodynamics, ed. by JPMcCullough, DWScott, v. 1, NY - L., 1968.
© M. Ю. Панов.