Generation of Plasmid Vectors Expressing FLAG-tagged Proteins Under the Regulation of Human Elongation Factor-1α Promoter Using Gibson Assembly
Робочий процес протоколу, який потім буде показано на малюнку 2А. Ми хотіли, щоб клонувати CstF-64 і мутантних CstF-64 білків, злиті з 3xFLAG тега під експресивного регулювання hEF1α промотор (рис 2B і рис 3). Плазміди, що містить hEF1α потім 3xFLAG-тега не був доступний для нас. Проте, такі плазміди були доступні: pcDNA 3,1 Мус-His (; щедрий подарунок від Мікаела Янсен), hEF1α містить плазміди (щедрий подарунок від Младен Йовчев) і миша CstF-64 плазміди 12 (Малюнок 3). Вся послідовність конструкції (и) був зібраний за допомогою додатків нуклеотидів і редагування тексту (рисунок 3, см таблицю обладнання). Згодом, послідовність (і) була розділена на чотири зручних штук (рис 2B, червоних блоків і рис 3), відповідних наявними плазмідних ДНК. Посилення рrimers були розроблені з використанням інструменту праймера покоління (табл обладнання) з обмеженнями 4 - 6 фрагментів з мінімальним перекриттям 25 нт, створена в "Змінити параметри Гібсон Асамблеї" у спливаючому вікні. NheI і NotI сайти рестрикції були включені в підбір праймерів з метою виявлення належним чином зібрані плазміди. Сайт NheI розташований в праймера послідовності між pcDNA 3,1 і 5 'кінці промотора hEF1α. Сайт NotI знаходиться після стоп-кодону (УЗА) з CstF-64 і pcDNA 3,1 векторного скелета. При одночасному травлення з обох ферментів ДНК фрагмент, що складається з hEF1α промотор, 3xFLAG і CstF-64 або мутантного CstF-64 буде випущений (див нижче і 2В). Грунтовки були замовлені в найменшій можливій масштабі і обессолівают. Друга частина промотора, що містить hEF1α 3xFLAG-тега фрагмента ДНК (490 п.н., 2В, малюнок 3) був придбаний у вигляді одного фрагмента (ів sDNAEE Таблиця матеріалів). Фрагменти ДНК, що використовуються в реакції збірки ампліфікували з використанням ДНК-Pol (табл матеріалів). ДНК-фрагменти hEF1α промоутер частини 1, hEF1α промоутер частина 2, повна довжина і мутант CstF-64 були посилені одночасно в окремі пробірки протягом 28 циклів (рис 4а), відповідно до рекомендацій постачальника ПММ ДНК (див таблицю матеріалів, для кожного циклу денатурації 7 сек при 98 ° С, відпал 45 секунд при 55 ° С, подовження 90 сек при 72 ° С). Спочатку pcDNA 3,1 основою ампліфікували протягом 22 циклів (з використанням тих же умов, що й вище, за винятком того часу елонгації, який був встановлений в 3 хв при 72 ° С). Проте, в результаті чого вихід ДНК не було достатньо, щоб використовувати в якості монтажного реакції (фіг.4). Таким чином, додаткове посилення проводили, щоб отримати достатню ДНК.
ПЛР-продукти получітьред з шаблону плазміди повинні бути розщеплює рестриктазой DpnI видалити плазмідної ДНК, які в іншому випадку будуть забруднювати отриману реакційну складання виробів і виробляти помилкового лікарською стійкістю бактеріальних колоній. Таким чином, ПЛР-продукти розщеплює рестриктазой DpnI, який розщеплює метильованих і геми-метильований плазмідної ДНК, виділеної з греблі + E. штами кишкової палички. ПЛР-продукти отримували з використанням синтетичних фрагментів ДНК, як шаблони не повинні бути переварювали DpnI так хімічно синтезованої ДНК не містить метиловані або геми-метилованих підстав.
Фрагменти ДНК очищають і концентрують протягом очищення ДНК магнітних кульок (табл матеріалів), як описано в стадії протоколу 4. ПЛР для pcDNA 3,1 векторного скелета були об'єднані разом і кількість очищення ДНК використовували магнітні кульки були відповідним чином скориговані. Вихід ДНК определяліс допомогою спектрофотометра (Таблиці 1 і обладнання). Реакції з монтажу CstF-64 і мутантних CstF-64 конструкції були зібрані на льоду (Таблиця 1). 3-кратний молярний надлишок ДНК-фрагментів, що розглядаються як "вставками" був використаний (таблиця 1, рисунок 3). Кінцевий обсяг змішаних фрагментів ДНК доводили до 10 мкл водою і 10 мкл додавали майстер збірки суміші (2x). Реакції змішували і інкубували при 50 ° С протягом 1 години. Позитивна реакція управління також зібрані відповідно до рекомендації комплект керівництві GA і інкубували одночасно з CstF-64 реакцій CstF-64 і мутантних. Відповідно до рекомендації в протоколі, 2 мкл кожної з реакцій збірки були перетворені в хімічно компетентну E. паличка поставляється з монтажними набору для клонування (таблиця матеріалів). Перетворення проводили, як описано в комплектеРуководство. Позитивні клони обирали на чашках з ампіциліном / LB пластинах. 6 колоній на кожній реакції збірки були обрані випадковим чином, щоб розмножити. Плазмида ДНК виділяли з використанням міні-набору виділення плазмід (табл матеріалів). У кремній перетравлення конструкцій рестріктазамі NheI і NotI в результаті двох фрагментів з розмірами 4590 п.н., 3032 п.н. для CstF-64 і 4590 п.о., 2711 б.п. мутанта CstF-64 (рис 2B і рис 4б). Травлення рестріктазамі HindIII і NotI в результаті трьох фрагментів з наступними розмірами: 5872 б.п., 1005 б.п., а 745 б.п. (CstF-64) і 5872 б.п., 1005 б.п., а 424 б.п. (мутант CstF-64, 2В і фіг.4С). Дійсно, травлення, ізольованих плазмід відобразиться очікуваний характерні моделі (рис 4, б). Слід зазначити, що 424 п.о. фрагмент ДНК отримують шляхом гідролізу за допомогою HindIII і NotI в CstF-64 мутантаплазміди на фігурі 4C слабо забарвлених через його невеликого розміру. 2 з 6 ізольованих плазмід були спрямовані для секвенування. Ми впорядкували промотор hEF1α і CstF-64 або мутант CstF-64 частини конструкцій, щоб переконатися, що немає делеции, вставки або заміни. Ми рекомендуємо секвенування ДНК-конструкцій в результаті цього або будь-якого ПЛР-протоколу. Секвенування показало, що один з кожної секвенували плазміди містив очікувану послідовність в області hEF1α, 3xFLAG-тега і CstF-64 або мутантного CstF-64. Кожен з інших плазмід мав точкову мутацію, введені під час ампліфікації відповідного фрагмента ДНК. Експресія плазміди, що містить CstF-64 в мишачих ембріональних стовбурових клітинах, отримують рясну кількість екзогенного білка, порівнянну з дикого типу експресії 17.
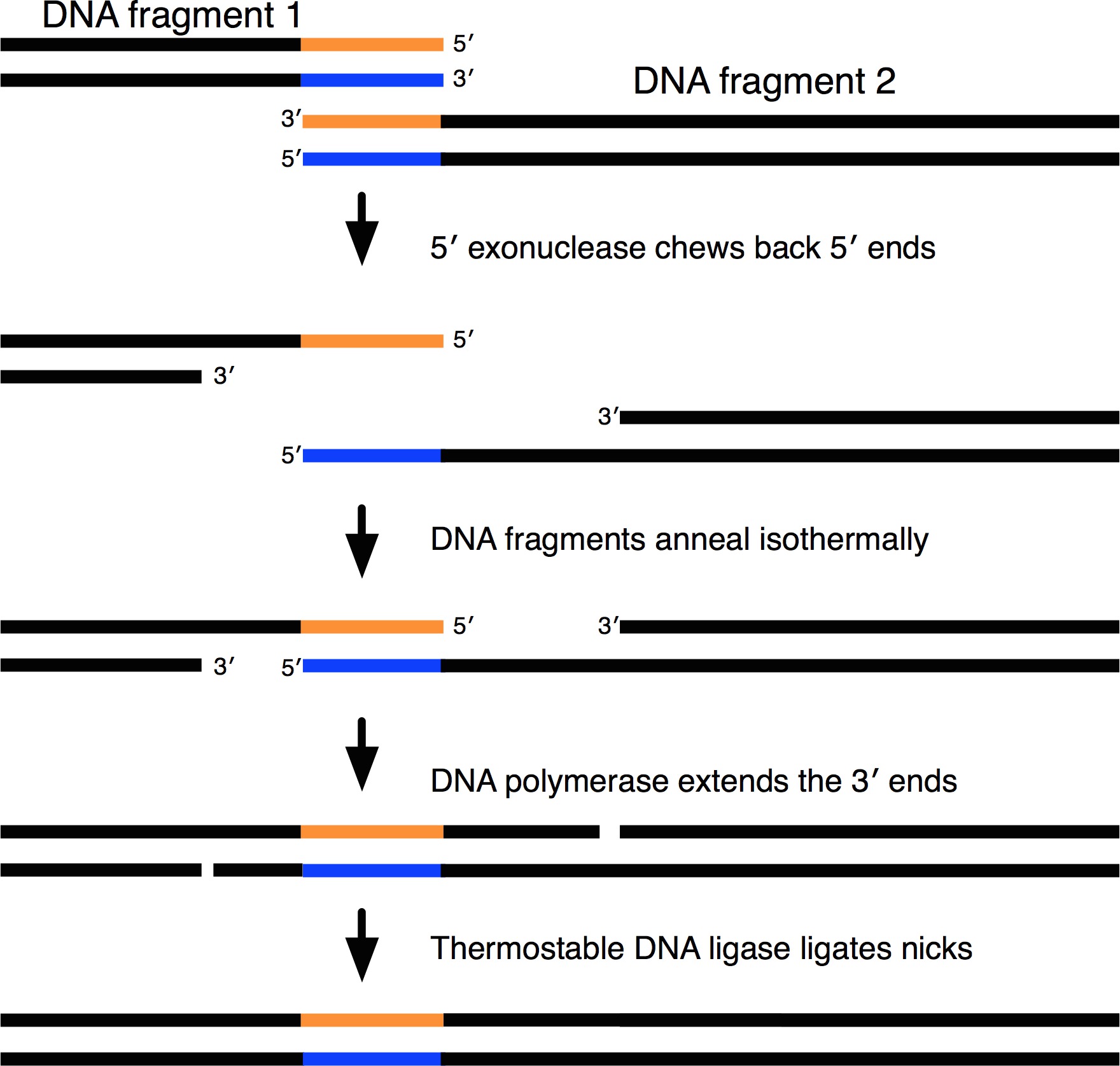
Малюнок 1. Схематичне зображення механізму Gibson зборів. Фрагментів ДНК з перекриттям кінців були ізотермічні зібрані в одній безперервній послідовності. Перекриття решт перший жують назад 5 "екзонуклеаза, який поступово термоінактівірованной. Отже, різні фрагменти ДНК з перекриттям кінців буде літати ізотермічні. ДНК-полімераза буде заповнити прогалини і термостабільної ДНК-лігази ligates ників. Будь ласка, натисніть тут, щоб побачити збільшену версію цієї цифри.
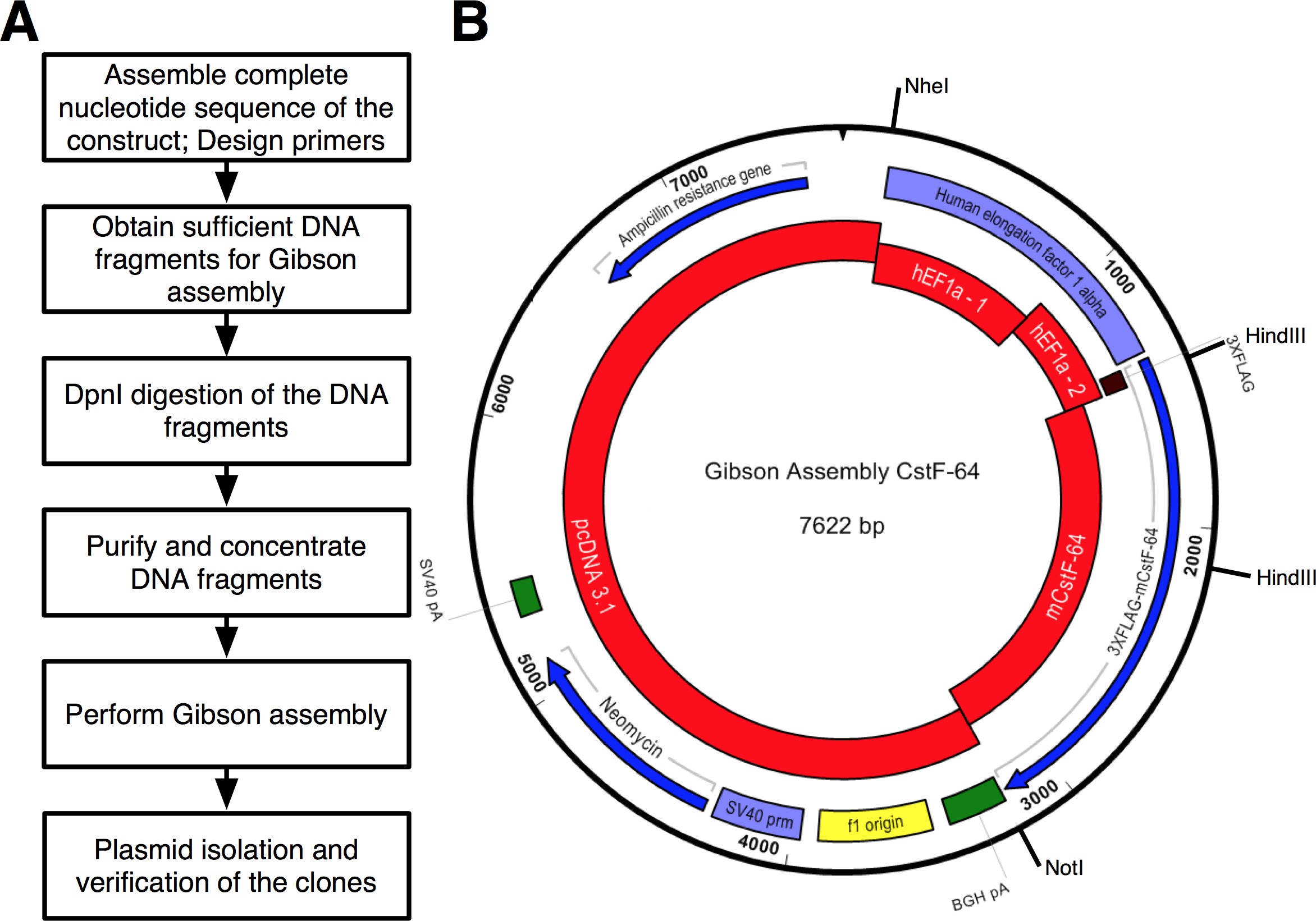
Малюнок 2. (А) Блок-схема протоколу описано для збірки клонування. (B) Подання плазміди, PGA-CstF-64 створений за допомогою GA комплект червоний - фрагменти ДНК, які використовуються в реакції збірки :. PcDNA3,1; hEF1α промоутер частина 1 (hEF1a - 1); hEF1α промоутер частина 2 (hEF1a - 2) замовити в якості синтетичної ДНК; миша CstF-64 (mCstF-64). Blue - відкриті рамки зчитування. Фіолетовий - вірусні і не вірусні промотори. Зелений -. Розщеплення і поліаденілювання регіони Будь ласка, натисніть тут, щоб побачити збільшену версію цієї цифри.
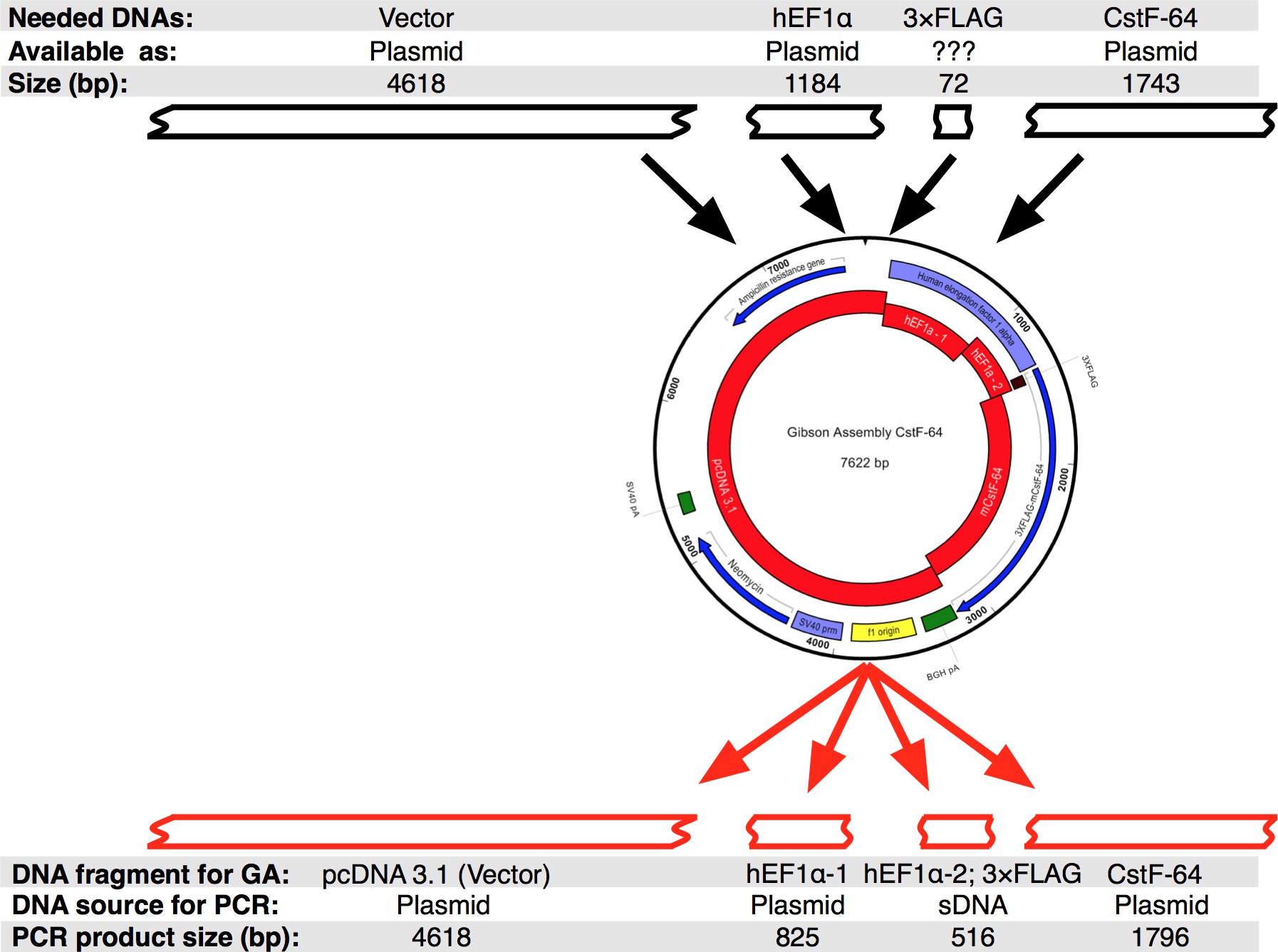
Малюнок 3. Дизайн Гібсон збірки CstF-64 плазміди. Чорні ящики представляють собою фрагменти ДНК, які були доступні для розробки єдиного вузла Gibson CstF-64 в послідовності силікомарганцю. Потім послідовність була розділена на чотири частини ДНК, які були ампліфікувати за допомогою ПЛР. Зверніть увагу, що через невеликого розміру 3xFLAG тегом послідовність була розроблена в якості sDNA разом з ПР hEF1α omoter частина 2. Будь ласка, натисніть тут, щоб побачити збільшену версію цієї цифри.
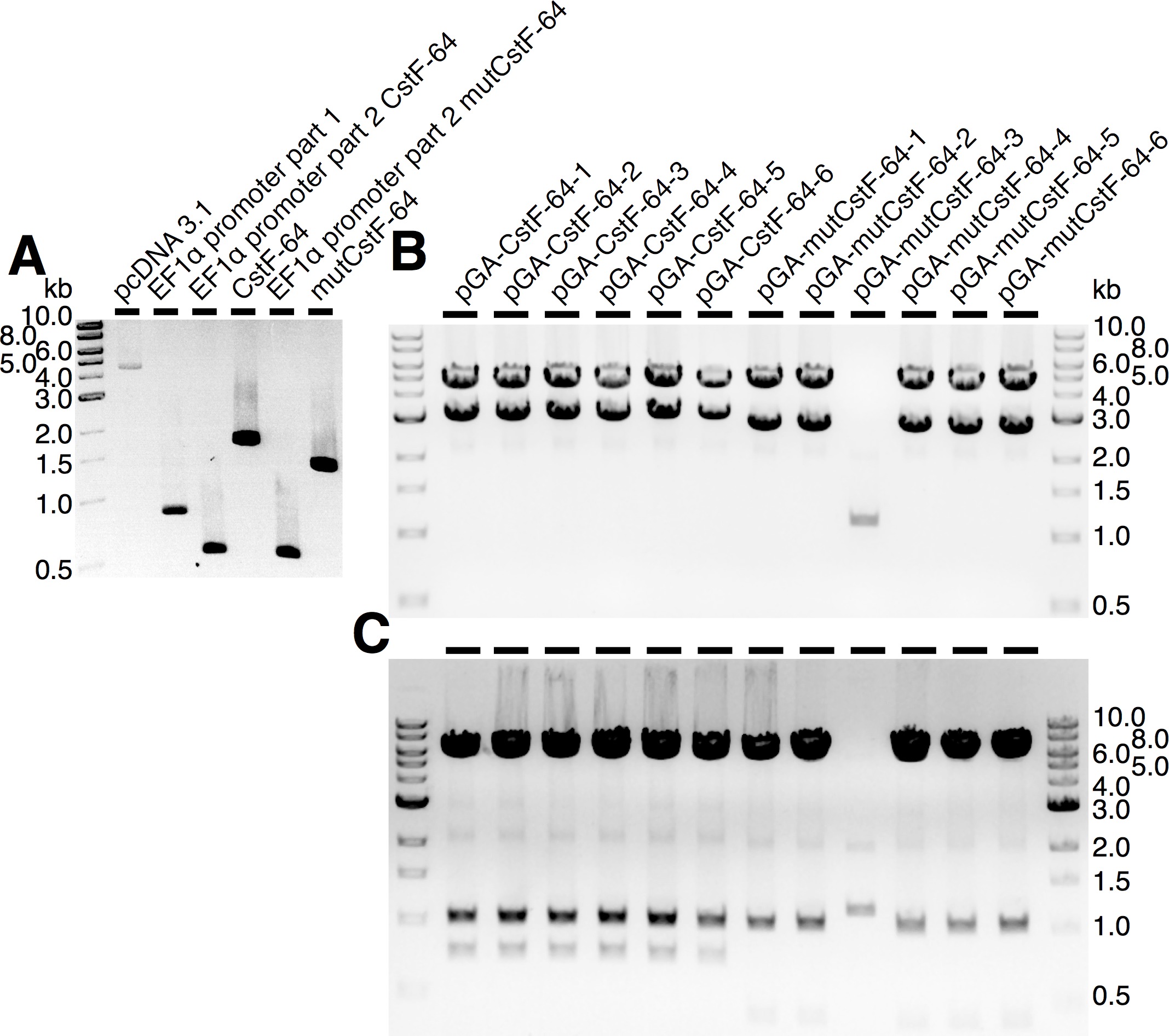
Малюнок 4. ПЛР фрагментів ДНК, які використовуються в клонуванні реакцій і представницького ферментами рестрикції плазмід, отриманих (А) Характерні ПЛР з використанням гарячої почати високоякісний 2x основний суміші для фрагментів ДНК, які використовуються в реакції по збірці :. (Б) представник плазміди hEF1α, повна довжина CstF-64, pcDNA 3,1 конструкт (PGA-CstF-64) і hEF1α, мутант CstF-64, pcDNA 3,1 конструкт (PGA-mutCstF-64) розщеплює NheI і NotI. (В) те саме, що і в плазміди B переварювали HindIII і NotI ферментів. "_ Blank"> Натисніть тут, щоб подивитися велику версію цієї цифри.
Ім'я фрагментів ДНК Очікуваний розмір (BP) Concn. (Нг / мкл) Розведений до (нг / мкл) мкл використовується в GA CstF-64 з розбавлених мкл використовується в GA mutCstF-64, з розбавлених Молярна ставлення (INS: VEC) pcDNA 3.1 (вектор) 4618 158 нерозбавлений 1 + 1 hEF1_ промоутер частина 1 825 213 75 1 1 3: 1 hEF1_ промоутер частина 2 для CstF-64 516 229 50 1 3: 1 Cstf-64 1796 161 нерозбавлений 1 3: 1 hEF1_ промоутер частина 2 для мутанта CstF-64 516 199 50 1 3: 1 мутант CstF-64 1448 201 171 1 3: 1
Таблиця 1. Вихід з фрагментів ДНК після концентрації на магнітні кульки, розведення і налаштувати реакцій збірки.